衛福部核准宇越生醫 與三軍總醫院新藥一期臨床試驗合作計畫
台北訊 2020.08.26

宇越生醫為專注CAR-T細胞療法之新藥研發公司,圖為宇越生醫董事長秦嘉鴻。圖/業者提供
由宇越生醫與三軍總醫院攜手合作「CAR-T細胞治療淋巴瘤臨床試驗」計畫,此新藥一期臨床試驗已獲衛福部核准執行,預期CAR-T細胞治療的問市,將是癌友的一大福音,更是國內癌症治療的重大突破。 宇越生醫董事長秦嘉鴻表示,2017年全球B細胞淋巴瘤治療耗盡57億美元醫療成本,且預估2025年其全球治療需求將達到200億美元,臺灣每年約新增2500位相關病例,其中難治或復發比例約3成,這些癌友迫切需要新式細胞治療藥物挽救生命。宇越生醫與三軍總醫院的合作試驗計劃,共同創造臺灣腫瘤治療的新紀元,力拼於2025年取得上市許可並正式於醫療系統使用,進一步嘉惠淋巴瘤及血癌患者,也有機會納入健保給付。 。

宇越生醫與三軍總醫院攜手合作「CAR-T細胞治療淋巴瘤臨床試驗」。圖/業者提供
「CAR-T細胞治療淋巴瘤臨床試驗」計畫啟動
三軍總醫院院長王智弘表示, CAR-T細胞治療B細胞淋巴瘤在2017年由美國FDA全球首次批准上市臨床使用,但生產時間長、技術門檻高、收費貴,無法滿足未來B細胞淋巴瘤患者治療需求,更使得經濟狀況不佳的癌友因無力負擔而無法接受良好的治療,因而國內自主開發CAR-T 細胞治療產品確有急迫性與必要性。試驗主持人何景良表示,CAR-T 的主要原理是利用基因工程改造T淋巴細胞,讓其表現CAR(嵌合抗原受體),透過CAR識別癌細胞,第一期臨床試驗評估 Welgenaleucel (UWC19) 對復發或難治B細胞非杰金氏淋巴瘤病患之安全性與耐受性。

宇越生醫與三軍總醫院的合作試驗計劃,力拼於2025年取得上市許可。圖/業者提供
力拼2025年取得上市許可
目前在歐美已有 4 家廠商 6 種CAR-T產品上市,其治療的適應症有B細胞淋巴癌、B細胞白血病及多發性骨髓瘤,1 劑約 1400 萬台幣,價格不斐;另外,CAR-T 免疫細胞療法,在台灣只有一家藥物取得正式核准,其單價為 1100 萬台幣。因此,病友若要接受 CAR-T 免疫細胞療法需承受巨大財務壓力。除此之外接受 CAR-T 免疫細胞療法的管道為正在進行的臨床試驗,以及經主管單位同意的恩慈治療。 今年,「再生醫療三法」若立法通過,讓再生醫學能運用於幹細胞再生能力,修補受損的組織與器官,可望治癒過往被認為是絕症的疾病,讓癌症有被治癒的機會,不僅是人民的衷心期待,更是台灣「精準醫療」的一大進步。
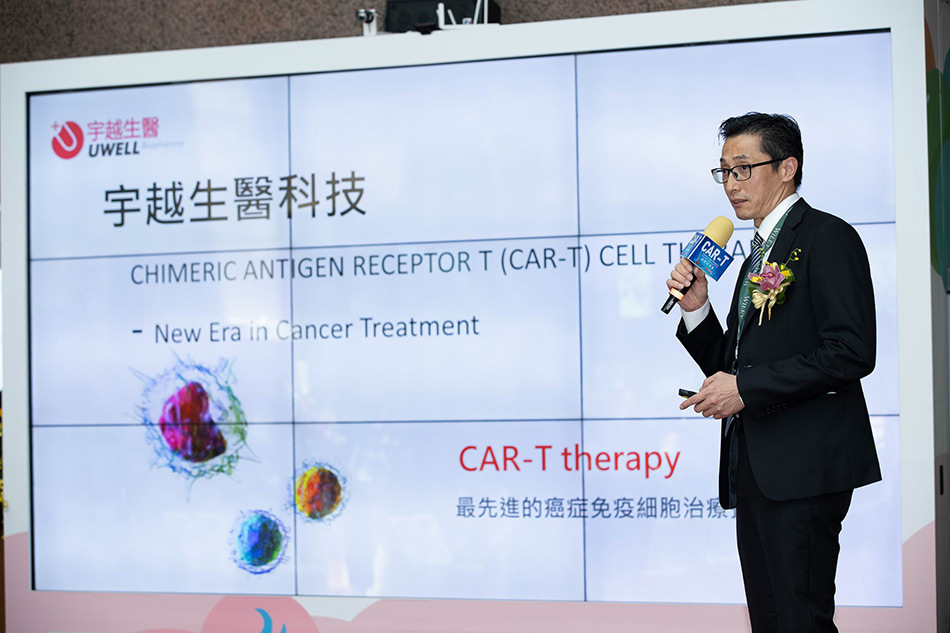
國內已有能力自主開發CAR-T 細胞治療產品,圖為宇越生醫副總經理郭正宜。圖/業者提供
宇越生醫為專注CAR-T細胞療法之新藥研發公司,致力於運用嵌合抗原受體T細胞(Chimeric Antigen Receptor T Cell, CAR-T cell) 技術治療淋巴瘤、血癌與其他實體腫瘤等各種癌症之新藥開發。國內醫界及癌友高度期待宇越生醫與三軍總醫院合作計畫案的順利成功,為癌症治療帶來新希望,也能因為新藥的自主研發,嘉惠經濟狀況不佳的癌友能接受良好的治療。
資料來源:工商時報
